文章来源: 倍可亲 – 新闻取自各大新闻媒体,新闻内容并不代表本网立场!
核心提要:
1. 因120万元一针而火爆的天价抗癌神药CAR-T细胞免疫疗法,正面临美国食品和药物管理局(FDA)紧急警告:患者接受治疗后可能出现第二恶性肿瘤。FDA已收到25例治疗后出现T细胞恶性肿瘤的报告,其中严重患者已经死亡。这款疗法不仅具有价格高昂、给药等待时间长、治疗后复发快等缺点,还陷入了引发第二种癌症的安全性风波。
2. FDA已要求6款CAR-T产品添加黑框警告,并指出使用靶向BCMA或CD19的CAR-T治疗可能导致T细胞恶性肿瘤,其中包括国内传奇生物制药的西达基奥仑赛。
3. 国内已获批上市的四款CAR-T疗法分别为复星凯特的阿基仑赛、药明巨诺的瑞基奥仑赛、驯鹿生物的伊基奥仑赛,以及合源生物的纳基奥仑赛。其中,阿基仑赛引进自吉利德子公司Kite制药的Yescarta技术,这一技术已在美国FDA黑框警告名单上。目前有关部门还没有就有关CAR-T药物治疗后出现第二种癌症的情况发表意见。业界对于管理部门是否会借鉴FDA的调查,对国内的几款已批准的CAR-T药物是否进行黑框警告或要求进行类似的长期副作用试验与报告,值得观察。
120万一针天价抗癌神药 CAR-T 会导致第二种癌症?FDA收到 25 例报告,急令添加黑框警告,该警告中涉及中国的一款药物
在国内曾以120万元一针天价抗癌神药闻名的CAR-T免疫疗法,自去年11月深陷致癌风波后,再遇困境.
1月19日,美国食品和药物管理局(FDA)紧急发布警告,接受CAR-T 细胞免疫疗法的癌症患者可能出现第二恶性肿瘤(T细胞恶性肿瘤)。
1月24日,FDA 发言人卡莉·普夫劳姆 (Carly Pflaum) 表示,FDA已向这些疗法的所有制造商发出了通知信,要求他们在美国上市的所有六款CAR-T细胞治疗产品,添加额外的黑框警告。
黑框警告内容为“使用靶向BCMA或CD19的 CAR-T 细胞治疗产品治疗后,可能会继发T细胞恶性肿瘤”,并在药品说明书中添加注意事项、不良反应、患者咨询信息和患者医学指引(FDA对产品说明书的特殊要求)等7个条目做了统一并且具体的要求。
卡莉承认,FDA已收到 25 例 CAR-T 细胞免疫疗法治疗后出现所递交的 “T 细胞恶性肿瘤”报告。T细胞恶性肿瘤是高度侵袭性的血液系统肿瘤。
T 细胞是白细胞的一种,是CAR-T 疗法的支柱。这些技术的工作原理是利用患者的 T 细胞,在实验室中对其进行改造,使其能够攻击癌细胞,然后通过输注,将这些改造后的 T 细胞回输给患者。目前,已获批上市的CAR-T细胞治疗产品仅适用于血液肿瘤患者,如急性和慢性白血病、淋巴瘤和骨髓瘤等。
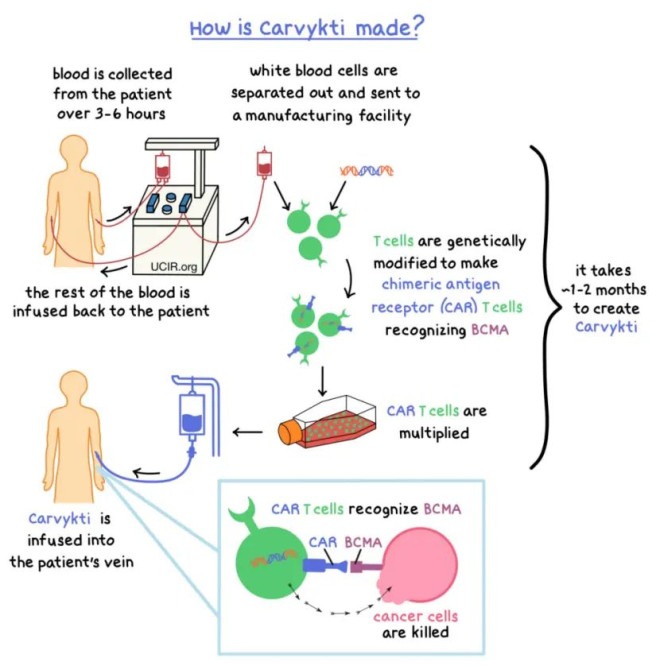
FDA目前批准的六款CAR-T细胞产品分别是:
1. Abecma(idecabtagene vicleucel)BMS 靶向 BCMA
2. Breyanzi(lisocabtagene maraleucel)BMS 靶向CD19
3. Carvykti(ciltacabtagene autoleucel)强生/传奇 靶向BCMA(中国公司)
4. Kymriah(tisagenlecleucel)诺华 靶向CD19
5. Tecartus(brexucabtagene autoleucel)吉利德 靶向CD19
6. Yescarta(axicabtagene ciloleucel)Kite/吉利德 靶向CD19

诺华公司的Kymriah 是FDA批准用于治疗白血病的第一个 CAR-T 癌症疗法 ,于 2017 年获得批准。这些疗法的最初批准包括 FDA所要求进行的 15 年随访研究,以长期评估安全性和继发性的恶性肿瘤风险。
自美国第一款CAR-T 细胞免疫疗法获批六年后,美国已有超 27,000 人接受相关药物的治疗。但关于其会导致继发性癌症发生的案例,则开始不断被报告出来。
FDA 生物制品评估与研究中心主任皮特·马克斯 (Peter Marks) 博士在一份报告中表示,截至2023年底,他们已收到19例在接受靶向BCMA或CD19的自体CAR-T细胞免疫疗法治疗后的患者中,出现了T细胞恶性肿瘤的报告。这些报告来自临床试验或上市后CAR-T细胞疗法不良事件的数据,其中一些严重患者已经死亡。
临床研究数据表明,CAR-T 细胞治疗产品在各种人体系统中所发生的严重不良反应主要包括免疫系统毒性(如细胞因子释放综合征,CRS)、神经系统毒性(如脑病、语言障碍等)、呼吸系统相关器质性病变(如缺氧、呼吸衰竭等)、心血管系统毒性等。
但治疗后出现了第二种癌症的风险,则令这种昂贵的癌症治疗方法陷入了困境。据了解,FDA临床试验和上市后不良事件(AE)数据库中,目前上市的全部6款产品均出现了治疗后新的T细胞淋巴瘤病例。